
L’acidità e la basicità sono concetti fondamentali nella chimica e svolgono un ruolo cruciale in numerosi processi biologici e alimentari. In particolare, il succo di limone è spesso considerato un esempio classico di sostanza acida, principalmente per la presenza di acido citrico e vitamina C (acido ascorbico). Tuttavia, la relazione tra acidità del cibo e il suo effetto sull’organismo è più complessa di quanto sembri a prima vista. Inoltre, rimedi tradizionali come la combinazione di limone e bicarbonato di sodio, comunemente utilizzati per favorire la digestione, coinvolgono processi chimici e fisici che meritano un’analisi approfondita.
Questo articolo si propone di chiarire le differenze tra i principali acidi presenti nel limone, esplorare il comportamento della vitamina C nell’organismo, spiegare la chimica della neutralizzazione acido-base, e illustrare come i rimedi casalinghi agiscano non solo chimicamente ma anche meccanicamente attraverso fenomeni come l’effervescenza.
Acido citrico e acido ascorbico: caratteristiche e differenze
Il succo di limone contiene diversi acidi, tra cui i più importanti sono l’acido citrico e l’acido ascorbico, comunemente noto come vitamina C.
Pur essendo entrambi acidi, presentano strutture chimiche e funzioni molto diverse.
- Acido citrico: è un acido organico presente in molti frutti agrumati. Chimicamente, è un acido tricarbossilico con formula C₆H₈O₇. Ha un sapore molto aspro ed è responsabile dell’acidità caratteristica del succo di limone. Nell’organismo umano, l’acido citrico fa parte del ciclo di Krebs, un processo fondamentale per la produzione di energia.
- Acido ascorbico (vitamina C): è una molecola con formula C₆H₈O₆, strutturalmente diversa dall’acido citrico. È una vitamina essenziale per l’uomo, con proprietà antiossidanti e ruoli importanti nella sintesi del collagene, nel sistema immunitario e nell’assorbimento del ferro. Anche se è un acido, il suo effetto nell’organismo non è semplicemente quello di aumentare l’acidità, come sarà approfondito in seguito.
Le differenze tra questi due acidi sono quindi sostanziali sia dal punto di vista chimico sia funzionale.
La vitamina C: acida in chimica, basificante nell’organismo
L’acido ascorbico, comunemente chiamato vitamina C, è una sostanza acida per definizione chimica, poiché può cedere protoni (ioni H⁺) in soluzione acquosa. Tuttavia, il suo effetto sul pH dell’organismo è diverso rispetto a quanto ci si potrebbe aspettare da un acido tradizionale.
Quando la vitamina C viene metabolizzata nel corpo umano, i suoi prodotti di degradazione sono alcalini (basici). Questo significa che, nonostante la sua natura acida, il bilancio acido-base complessivo del corpo può spostarsi verso una condizione più basica grazie al metabolismo della vitamina C.
Questo fenomeno è noto come effetto basificante della vitamina C. È importante sottolineare che l’effetto basificante si riferisce all’impatto metabolico, e non al pH immediato di una soluzione di vitamina C esterna.
Chimica della neutralizzazione: acidi e basi in equilibrio
Il principio fondamentale della chimica degli acidi e delle basi è la reazione di neutralizzazione, in cui un acido e una base reagiscono per formare un sale e acqua. Questa reazione porta all’annullamento parziale o totale delle caratteristiche acide e basiche iniziali, con un conseguente pH più neutro.
Un esempio molto comune è la reazione tra l’acido citrico (presente nel limone) e il bicarbonato di sodio, una base debole. La reazione produce anidride carbonica (CO₂), acqua e citrato di sodio (un sale):
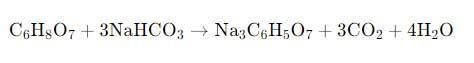
L’anidride carbonica si manifesta come bollicine di gas, responsabili dell’effervescenza osservata.
Preparare la vitamina C in casa: fonti e tecniche di estrazione
La vitamina C (acido ascorbico) è presente in abbondanza in molti alimenti, soprattutto agrumi, kiwi, peperoni, fragole, cavoli e ortaggi a foglia verde. Tuttavia, è una sostanza idrosolubile e termolabile, quindi si degrada facilmente con la cottura, la luce e l’esposizione all’aria.
Metodi semplici per ottenere vitamina C in forma naturale:
- Infusi a freddo di agrumi e ortaggi crudi
- Spremere arance, limoni, pompelmi o frullare frutti ricchi di vitamina C come kiwi o fragole.
- Lasciare riposare in acqua fredda o a temperatura ambiente per massimo 2 ore.
- Bere immediatamente per evitare ossidazione.
- Polvere casalinga di scorza d’arancia o limone (essiccata a bassa temperatura)
- Usare solo scorze non trattate (biologiche).
- Rimuovere la parte bianca interna (albedo) e grattugiare la scorza.
- Essiccare a bassa temperatura (max 40 °C) per preservare il contenuto vitaminico.
- Una volta secca, polverizzare e conservare al riparo da luce e umidità.
- Si può aggiungere a tisane, frullati o yogurt.
- Succo fresco di acerola o camu camu (per chi coltiva o reperisce)
- L’acerola contiene fino a 30 volte più vitamina C di un’arancia.
- Anche in piccole quantità, è un integratore naturale molto efficace.
Nota importante:
L’acido ascorbico puro può anche essere acquistato in polvere nei negozi specializzati, ma non può essere prodotto in casa con metodi semplici senza sintesi chimica, che richiede condizioni di laboratorio. Tuttavia, estrazioni naturali e tecniche di conservazione corrette permettono di preservarne una buona quantità.
Limone e bicarbonato: il rimedio tradizionale spiegato dalla chimica
La combinazione di succo di limone e bicarbonato di sodio è un rimedio molto diffuso nella tradizione popolare, spesso utilizzato per favorire la digestione o come “alcalinizzante naturale”. Alla base del suo effetto percepito c’è una reazione chimica ben definita, accompagnata da una componente fisica evidente: l’effervescenza.
La reazione chimica
Come anticipato, l’acido citrico presente nel limone reagisce con il bicarbonato di sodio (NaHCO₃), una base debole. La reazione produce:
- Anidride carbonica (CO₂): gas responsabile della formazione delle bollicine;
- Acqua (H₂O);
- Un sale (citrato di sodio).
Effetto digestivo
La CO₂ liberata durante la reazione provoca un effetto meccanico simile a una spinta gassosa verso l’alto. Questo può favorire:
- L’eruttazione (ruttino), che riduce la pressione gastrica e dà una sensazione di sollievo;
- La rimozione fisica di residui alimentari lungo la mucosa gastrica e l’esofago, in parte per l’azione delle bollicine, che possono avere un effetto “schiumogeno” delicato, simile a quello di un detergente blando.
Considerazioni fisiologiche
Sebbene il sollievo percepito sia reale, l’assunzione frequente di bicarbonato non è consigliata, poiché può interferire con la produzione di acido cloridrico nello stomaco e alterare temporaneamente il pH gastrico. Inoltre, l’anidride carbonica in eccesso può peggiorare il reflusso gastroesofageo in soggetti predisposti (per esempio con un cardias incompetente).
Cosa accade nel corpo: digestione, assorbimento e risposta fisiologica
Quando si assume una miscela di limone e bicarbonato, l’organismo reagisce attraverso una serie di processi fisici e biochimici che coinvolgono il tratto gastrointestinale, il sistema tampone ematico e il metabolismo cellulare. Analizziamo i principali eventi.
Nello stomaco
Nel momento in cui il bicarbonato entra in contatto con l’acido citrico e l’acido cloridrico gastrico (HCl), si verifica una rapida reazione di neutralizzazione:NaHCO3+HCl→NaCl+CO2+H2O\text{NaHCO}_3 + \text{HCl} \rightarrow \text{NaCl} + \text{CO}_2 + \text{H}_2\text{O}NaHCO3+HCl→NaCl+CO2+H2O
Questo comporta:
- Aumento temporaneo del pH gastrico (meno acidità);
- Formazione di anidride carbonica (CO₂) che può accumularsi causando eruttazioni o, in soggetti sensibili, gonfiore o rigurgito.
Questa neutralizzazione può dare un sollievo immediato in caso di bruciore di stomaco o digestione lenta, ma non rappresenta una soluzione duratura: la risposta del corpo è quella di ristabilire l’acidità producendo nuovo acido cloridrico. Questo fenomeno è noto come “effetto rebound”.
Nell’intestino
Una volta transitato oltre lo stomaco, il contenuto neutralizzato passa nel duodeno, dove i succhi biliari e pancreatici – già basici – contribuiscono ulteriormente a completare la digestione. I sali di citrato formati nella reazione vengono assorbiti come sali minerali e metabolizzati.
Nel sangue e nei tessuti
I citrati e l’acido ascorbico (vitamina C) assorbiti possono partecipare al metabolismo cellulare e contribuire:
- al sistema tampone bicarbonato-emoglobina, che regola il pH del sangue;
- all’eliminazione renale degli acidi;
- alla modulazione dell’infiammazione e dello stress ossidativo, grazie all’azione antiossidante della vitamina C.
Il corpo tende naturalmente a mantenere il pH del sangue costante attorno a 7,4, attraverso complessi meccanismi di regolazione. Per questo, è scorretto pensare che assumere una sostanza acida o basica possa “alcalinizzare il sangue” in modo diretto e semplice. Tuttavia, alcuni alimenti o combinazioni, se ben dosati, possono favorire un ambiente metabolico meno acidificante, contribuendo alla salute generale.
“Alcalinizzante naturale”: cosa significa davvero?
Nel linguaggio popolare, molte sostanze vengono definite “alcalinizzanti” o “acidificanti” in base alla loro influenza sul corpo. Ma questa classificazione, spesso usata in medicina alternativa, non coincide sempre con il significato chimico reale.
Acido o basico? Attenzione alla confusione
In chimica, si definisce:
- Acida una sostanza con pH inferiore a < 7 (es. limone, acido citrico, acido ascorbico);
- Basica (alcalina) una sostanza con pH superiore > 7 (es. bicarbonato di sodio, ammoniaca);
- Il pH neutro è 7 (es. acqua distillata).
Tuttavia, nel contesto nutrizionale e fisiologico, il concetto cambia: una sostanza può essere acida al gusto o al pH, ma avere effetto alcalinizzante sul metabolismo.
Il paradosso del limone
Il limone ha un pH molto acido (circa 2,5), ma una volta metabolizzato nel fegato lascia residui alcalini, come i sali di citrato, che possono favorire l’eliminazione renale degli acidi. Questo lo rende, nella classificazione alimentare, “alcalinizzante” per l’organismo.
Il bicarbonato, invece, è basico già prima della digestione, ma non lascia “residui” alcalini duraturi nel metabolismo: la sua azione è transitoria e serve più a tamponare un’acidità alta momentanea (come quella gastrica).
Alcalinità metabolica: cosa conta davvero
In fisiologia, è utile parlare di carico acido renale potenziale (PRAL) (Potential Renal Acid Load), un indice che stima l’effetto di un alimento sull’equilibrio acido-base dell’organismo. Alimenti a PRAL negativo sono considerati alcalinizzanti (es. frutta, verdura), mentre quelli a PRAL positivo sono acidificanti (es. carni, formaggi stagionati, cereali raffinati).
Quindi, l’effetto finale sull’organismo non dipende dal pH dell’alimento in sé, ma da come viene metabolizzato e dai residui che lascia.
Tabella PRAL ampliata (valori in mEq/100 g)
Il PRAL (Potential Renal Acid Load) stima l’effetto acidificante o alcalinizzante di un alimento dopo il metabolismo. I valori sono espressi in mEq per 100 grammi di alimento.
- Un valore negativo indica un effetto alcalinizzante.
- Un valore positivo indica un effetto acidificante.
| Categoria | Alimento | PRAL | Effetto |
|---|---|---|---|
| Verdure | Finocchi | –3,0 | Alcalinizzante |
| Peperoni | –1,4 | Alcalinizzante | |
| Cipolle | –1,5 | Alcalinizzante | |
| Funghi champignon | –1,0 | Alcalinizzante | |
| Cavolfiore | –1,6 | Alcalinizzante | |
| Frutta | Kiwi | –5,6 | Alcalinizzante |
| Pompelmo | –3,3 | Alcalinizzante | |
| Fragole | –2,2 | Alcalinizzante | |
| Uva | –1,5 | Alcalinizzante | |
| Frutta secca/semi | Semi di girasole | +5,5 | Acidificante |
| Semi di zucca | +5,6 | Acidificante | |
| Semi di lino | +2,3 | Acidificante | |
| Legumi | Lenticchie cotte | +3,5 | Acidificante |
| Piselli | +1,2 | Leggermente acido | |
| Bevande vegetali | Latte di soia | –0,4 | Quasi neutro |
| Latte di mandorla (senza zucchero) | –1,0 | Alcalinizzante | |
| Latte di riso | +1,2 | Leggermente acido | |
| Latte d’avena | +0,5 | Leggermente acido | |
| Dolcificanti | Zucchero bianco | +0,0 | Neutro |
| Miele | +0,3 | Neutro/leggermente acido | |
| Sciroppo d’acero | –0,2 | Quasi neutro | |
| Stevia pura | 0,0 | Neutro | |
| Erbe e aromi | Prezzemolo fresco | –2,0 | Alcalinizzante |
| Basilico | –1,5 | Alcalinizzante | |
| Curcuma | –0,6 | Quasi neutro | |
| Zenzero fresco | –0,9 | Alcalinizzante | |
| Aglio | –2,5 | Alcalinizzante | |
| Altro | Cacao amaro in polvere | +6,5 | Acidificante |
| Cioccolato fondente (85%) | +3,2 | Acidificante | |
| Farina integrale di frumento | +12,3 | Fortemente acido |
Scarica la tabella completa in pdf
Conclusione: tra scienza e tradizione
L’antico rimedio del limone con bicarbonato rappresenta un perfetto esempio di incontro tra sapere popolare e conoscenza scientifica. Se da un lato l’uso empirico ha dato spesso risultati concreti – come la riduzione della sensazione di pesantezza o acidità – dall’altro la chimica e la fisiologia ci permettono oggi di comprendere a fondo i meccanismi che ne stanno alla base.
Abbiamo visto che:
- Il limone è acido al palato e nel pH, ma diventa alcalinizzante quando viene metabolizzato;
- Il bicarbonato di sodio è una base capace di tamponare l’acidità gastrica, generando CO₂ che può favorire la digestione meccanicamente;
- La reazione tra i due produce un sale (citrato), acqua e anidride carbonica, in un equilibrio chimico delicato ma ben descritto;
- L’assunzione occasionale può essere utile, ma non rappresenta una terapia e deve tener conto di eventuali condizioni individuali, come reflusso o ipertensione (il bicarbonato contiene sodio).
L’importante è distinguere tra effetto percepito e effetto fisiologico reale, senza mitizzare né demonizzare ciò che proviene dalla tradizione. La scienza non cancella la saggezza popolare: la illumina, la spiega e – quando necessario – la ricalibra.
